西南交大周绍兵/郭星AM:细菌外膜囊泡介导的肿瘤PD-L1自我阻断增强免疫治疗效果

免疫检查点抑制剂疗法阻断程序性死亡蛋白-1 (PD-1)及其主要配体PD-L1的结合,在某些肿瘤中取得了令人鼓舞的临床疗效。PD-1常于活化的淋巴细胞(如细胞毒性T细胞)中表达,可抑制细胞激活,诱导免疫耐受。而PD-L1于肿瘤细胞中过表达,与PD-1结合后,使T细胞的功能被抑制,无法杀伤肿瘤细胞。PD-1的单克隆抗体可以上调T细胞的生长和增殖,恢复T细胞杀伤肿瘤细胞的能力。但是这种疗法也存在着一些问题,如患者的反应率低(~20%)以及与这些抗体药物的长半衰期相关的副作用。此外,这些检查点抑制剂还与表达PD-L1的其他免疫细胞结合,包括抗原提呈细胞、活化的B细胞和巨噬细胞,从而干扰免疫功能。因此,在肿瘤组织中选择性地蓄积这些检查点抑制剂,然后集中作用于肿瘤细胞,对于提高免疫治疗效果和降低系统毒性至关重要。
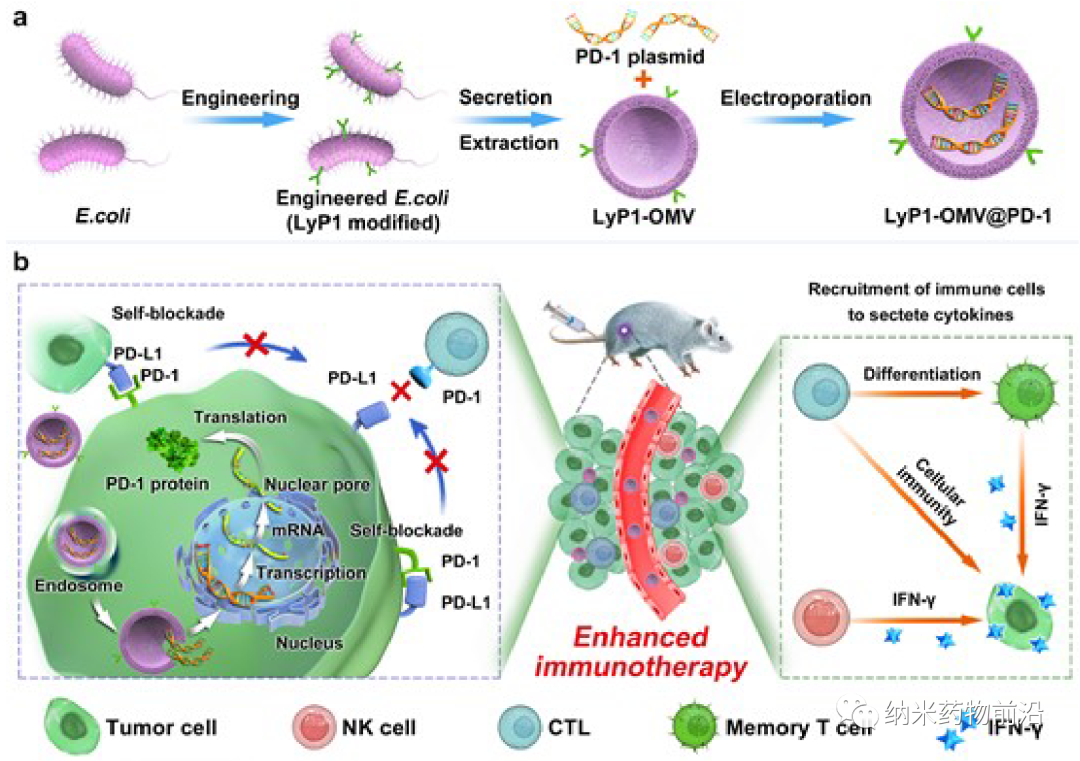
在此,西南交通大学周绍兵教授和郭星教授开发了含有PD-1质粒的LyP1多肽修饰的细菌外膜囊泡(LOMV),实现了PD-L1在肿瘤细胞中的自阻断。在大肠杆菌中表达靶向多肽LyP1,然后提取LOMVs,将PD-1质粒封装其中,即可得到LyP1-OMVs@PD-1纳米载体。静脉注射后,这些纳米载体通过OMV的靶向能力在肿瘤组织中蓄积,并通过LyP1内化于肿瘤细胞中,随后将PD-1质粒送入细胞核,导致肿瘤细胞表达PD-1。自表达的PD-1与自身及邻近肿瘤细胞表达的PD-L1结合,实现自我阻断,CTL被重新激活以消灭肿瘤细胞。同时,LOMV的外膜蛋白可将细胞毒性淋巴细胞和自然杀伤细胞招募到肿瘤组织,刺激其分泌IFN-γ,提高PD-1/PD-L1自阻断治疗的抗肿瘤活性。此外,OMVs将CTL分化为中央记忆T细胞,产生长效免疫。实验结果表明,与非靶向OMV相比,LyP1具有有效的靶向肿瘤和肿瘤内蓄积的能力。细菌外膜囊泡也将CTL和NK细胞吸引到肿瘤组织中,实现双重抗肿瘤效果。该策略对肿瘤的治疗效果提升显著,为肿瘤免疫治疗纳米药物的开发提供了新的思路。
原文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.202106307
本信息源自互联网仅供学术交流 ,如有侵权请联系我们立即删除。
| 温馨提示:苏州北科纳米供应产品仅用于科研,不能用于人体,不同批次产品规格性能有差异。网站部分文献案例图片源自互联网,图片仅供参考,请以实物为主,如有侵权请联系我们立即删除。 |
下一篇: 纳米医学产品1


